近日,学院杨飘萍教授、盖世丽教授及其所在团队在压电催化肿瘤治疗领域取得新突破,提出了一种通过B位铁掺杂调控稀土六方锰氧化物极化特性与化学键重构的新策略,显著提升了材料的压电催化性能并诱导肿瘤细胞铁死亡。在该方案的指导下,动物实验中异种移植CT26肿瘤的小鼠在超声照射下,肿瘤抑制效果显著。该研究首次将稀土锰酸盐材料成功应用于压电催化治疗,为稀土功能材料在“医工交叉”领域的应用提供了新思路,有望推动我国生物医用纳米材料的设计与临床应用发展。
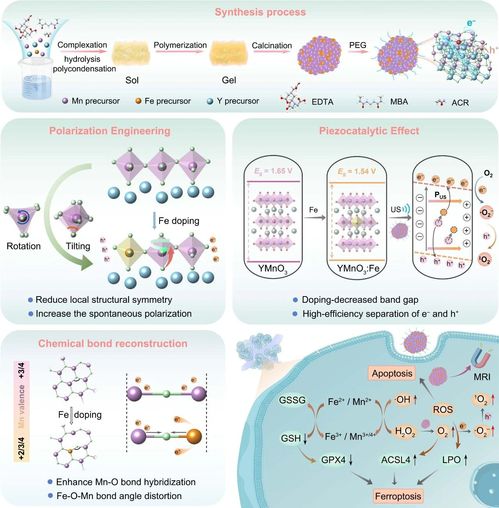
YMnO3:Fe NPs的合成过程、增强的压电催化和治疗机制示意图
相关成果以“通过铁离子占据B位掺杂实现稀土六方锰氧化物的极化工程与化学键重构及其在压电催化治疗与铁死亡中的应用”为题,发表在化学领域顶级期刊《美国化学会志》(Journal of the American Chemical Society, JACS)上。博士生杨美琪为论文第一作者,盖世丽教授,杨飘萍教授为共同通讯作者,哈尔滨工程大学为第一单位。
传统恶性肿瘤治疗方法如手术、化疗和放疗常伴随明显副作用和预后不佳问题。压电催化治疗作为一种新型非侵入性治疗手段,利用超声波激活压电纳米材料,在肿瘤内部产生电场,可以更精准、更温和地杀伤癌细胞。但目前传统压电材料存在自发极化弱、载流子分离效率低、活性氧产率不足等问题,响应性能还有待提高。
为解决上述问题,杨飘萍、盖世丽教授团队设计了一种铁掺杂六方锰氧化物纳米颗粒(YMnO3:Fe NPs),通过独特的“极化工程+化学键重构”双策略,让材料的“催化”能力大幅提升。
该研究克服了传统压电材料催化效率低、治疗深度有限的问题。在超声辐照下,材料实现精准激活,通过压电效应产生内建电场,表现出多重酶活性(过氧化物酶、氧化酶、过氧化氢酶)与压电催化协同效应,直接催化生成杀伤癌细胞的活性氧,大幅提升细胞内活性氧水平,诱导线粒体膜电位损伤,最终导致肿瘤细胞凋亡。材料还能消耗细胞内抗氧化剂谷胱甘肽,下调GPX4蛋白并上调ACSL4蛋白,进一步增强铁死亡通路。此外,材料具备磁共振成像功能,可实现治疗过程的实时监测与引导,实现“治疗+监控”一体化。

